淺談歐盟的獨立醫療器材軟體及 APP 應用程式
本文作者:UL 健康科學部專案工程師 Teemo Chang
關於獨立出來的「醫療器材軟體註冊」,歐盟一直都沒有十分明確的指南。由於此為全新領域,而這之前就連獨立醫療器材軟體是否隸屬於醫療器材範疇內,都很有爭議。就現階段而言,每一個軟體皆應須分開判斷,但卻沒有一個判斷的準則,以龐大的中國市場來看,醫療器材的應用程式 (App) 法規更是處於完全空白領域,因此若要著手中國醫療器材 App 規範的制定,首先解析歐盟早先一步對獨立醫療器材軟體註冊的指南文件 (MEDDEV 2.1/6),將極具參考價值。
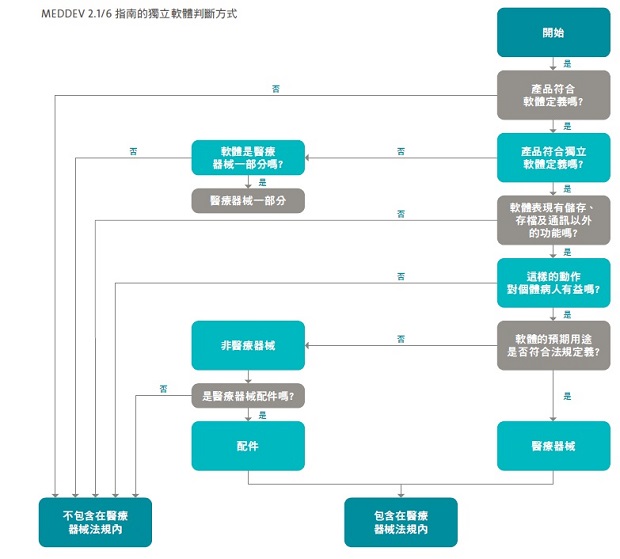
首先我們應先了解獨立軟體的定義:在 MEDDEV 2.1/6 中即已明確定義出所謂的獨立軟體就是不和上市醫療器材合併的軟體。而在該指南第一章節亦解釋什麼樣的獨立軟體才是醫療器材:基本上,獨立的軟體一定要有醫學上的用途,才可能算是醫療器械。另若未能符合 MDD (醫療器材) 或 IVDD (體外診斷醫療器材) 的定義,也不能算是醫療器械。以下圖表為指南所給的判斷方式。
獨立軟體的分類方式
首先我們可依據 93/42/EEC 條文,獨立軟體的定義符合有源醫療器材,此意謂在分類規裡,其能適用分類規則 9、10、11 及 12,如下所述:
分類規則 9 ── 可以交換能源或管理能源的治療型有源儀器被歸為 IIb,因此凡是管理或監控這類型有源治療儀器的獨立軟體,將合理地被歸為 IIb 類別。MEDDEV 2.1/6 指出兩個例子,一為用於計算要給予患者電離輻射劑量的放射治療計劃系統;另一為胰島素劑量計算的獨立軟體。這兩個例子皆屬於 IIb 類別。
分類規則 10 ── 有源醫療器材用來診斷使用則是歸為 Class IIa。舉例來說,常規時顯示心跳或其他生理參數的軟體歸類為 IIa 類別,但在急診室使用的同樣軟體則會被歸類為 IIb (因會導致立即的危險)。另若獨立軟體的使用會直接影響作用儀器的效能,其將自動落入該影響作用儀器的分類等級。
分類規則 12 ── 對於其他類別的有源醫療器材,根據分類規則 12,也有可能歸入 Class I。舉例來說,測量椎管間距或椎管的矢狀徑之矯形外科計劃軟體,就被歸為 Class I。至於針對「IVD 和與其相結合的軟體」,若獨立軟體是要被歸類為 IVD,將必須首先符合 98/79/EC 條文中所述的 IVD 定義。例如,若軟體是用來診斷三體綜合症風險,則其就算是符合 List B 的分類,因此必須遵循相關的認證路徑。
獨立軟體模組化
某些獨立軟體可被分成好幾個模組,這樣的模組有些可能會有醫學用途,有些則無,因此將產生新的問題:若具備多項功能的軟體,卻在某些部分是與醫學無關,能夠取得 CE 註冊嗎?作法是必須將模組分開來註冊。以下為指南中所提出的實例,將有助明確辨識那些軟體屬醫療器材:
- 醫院資訊系統:類似協助病人管理的過程,或是安排病人的預約掛號,或是帳單和保險等的這類資訊系統皆不被歸類於醫療器械。除非這些系統有其他的模組是和醫療器械相關。
- 決策支持系統:例如一些醫學資料庫或是病人的資料庫等可幫助專業的使用人員,使這些專業人員能因此對個別病人診斷、癒後、監控和治療的建議。依據本文圖表判斷方式,此類的軟體將可被定義為醫療器材。進一步來說,像是放射療法計畫系統,用來計算放射劑量,就被認為是控制、監控並且直接影響放射療效,因此被視為醫療器材;另放療藥物計畫系統,是用來計算個別病人的用藥劑量,也被視為醫療器材;還有電
腦輔助監測系統,可用來提供醫療狀況的訊息建議,也是醫療器械,如自動解讀 ECG 的軟體或是自動解讀 X 光片影像的軟體。 - 資訊系統:一些資訊系統僅有儲存、傳輸資料或是壓縮資料功能等,並不能算是醫療器材,除非其有其他模組。如電子病歷系統,由於只是單純取代傳統紙本型式的病人病歷,因此不符合醫療器材的定義,除非該系統另被建立其他類似診斷或醫療功能;其它如病例管理系統 (Patient Data Management System, PDMS) 或是臨床資料系統 (Clinical Information System, CIS),也都不屬於醫療器材。除此之外,某些管理 ECG 紀錄的
軟體, 僅有傳送或儲存功能, 則這些 ECG 系統也不能歸類為醫療器材;最後為放射科資訊系統 (Radiological Information System, RIS),因僅用來儲存和傳送放射性影像及病人資訊,一般來說雖包含病人識別、排行程及檢視結果的功能,但卻也不被視為醫療器械。 - 通訊系統:如 E-mail 系統、行動通訊系統、影像傳輸系統等,一般來說,都不歸類為醫療器材。例如遠程醫療系統就不能算是醫療器材,但遠端手術系統就會歸類為醫療器材,這是因為該系統能夠控制手術的表現,並且能夠操作手術機器人。
- 監控資料的網站系統:若有模組是預期來監控醫療器械效能的話,將會落入醫療器材的範圍內。舉例來說,監控心律調節器或是植入性心律整流去顫器的網站系統即屬於醫療器材;反之若無監控或是控制醫療器材的功能,將不會在醫療器材的範圍內。
- IVD軟體:
- 實驗室資計系統 (Laboratory Information System, LIS) 和工作區域管理系統 (Work Area Manager, WAM) ── 一般來說,這類系統對測試的樣本有分析的功能,主要的工作可讓 IVD 的分析者做技術上和臨床上的驗證,並且最後可以產出統計報告,並連結到外部資料庫。這樣的系統在指南中將不被視為是 IVD。
- 專家系統 ── 某些軟體是用來分析合併在一起的 IVD 結果 (也有可能是合併MD 產生的結果),這種會影響診斷結果的軟體將屬於 IVD 的範圍。如用基因結果分析和預測疾病以發展風險的軟體正屬於 IVD 範圍內;另使用核酸序列的結果演算病毒對各種藥的抗性,這類軟體亦屬於 IVD 範疇;而用於微生物學中鑑定臨床分離物或抗菌耐藥性的軟體也是 IVD。
- 原始數據的解釋系統 ── 當有一些軟體對於原始數據的解讀是必須的,這樣的軟體會被視為 IVD 配件的一部分,故屬於 IVD 範疇,如 ELISA 結果解讀的軟體就被當作 ELISA 的一部分。
本文參考文獻:
1 . European Commission MEDDEV 2.1/1 Definitions of “medical devices”, “accessory” and “manufacturer”.
2. European Commission Manual on borderline and classification in the Community Regulatory framework for medical devices.
3. MHRA guidance Medical device stand-alone software including apps (including IVDMDs).
4. MEDDEV 2.1/6, July 2016 Guideline on the qualification and classification of standalone software used in healthcare within the regulatory framework of medical devices.